鎢青銅化合物

簡介
鎢青銅(TB)是一類典型的非化學計量比化合物,通常呈立方晶體或四方晶體。不溶於水,也不溶於除氫氟酸以外所有的酸,但溶於鹼性試劑。其化學式可寫為MxWO3 (x =0~1),其中,常見的是M 為第一、二主族元素和稀土元素的鎢青銅。M 的品種和 x 數值的變化,可使它具有導體或半導體性質。結晶化學研究證明,鎢青銅實質上是鹼金屬原子插入 WO3 晶格之後而形成的固溶體。當所有的空位皆被充滿後,得到的化合物便是 MWO3 。鎢青銅的形成與鎢的可變原子價有關,如果只是部分空位被鹼金屬的原子所置換,則一部分鎢原子將由六價變為五價。
分類
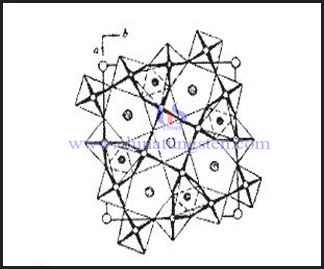
鎢青銅有著特殊的空間隧道結構,通常按照晶體結構進行分類,即分為鈣鈦礦結構鎢青銅(PTB)、四方結構鎢青銅(TTB)、六方結構鎢青銅(HTB)和共生結構鎢青銅(ITB)。由於鈣鈦礦狀鎢青銅和六方鎢青銅往往是非化學計量的化合物,因此可合為一類,即非化學計量的化合物。鎢青銅中W 以W6+、W5+和W4+等混合價態存在,從而使化合物整體電荷平衡。隧道結構和這種特殊的價態使其具有優異的性能,如電子和離子導電性、超導性、光學性能等。其在二次電池、電制變色和化學感測器等方面的應用引起廣泛的研究興趣。
1.非化學計量的鎢青銅
鈣鈦礦狀鎢青銅(PTB)和六方鎢青銅(HTB)是一類特殊的非化學計量鎢青銅化合物,其通式為MxWO3(0< x < 1 ),M通常是鹼金屬K、Na等,也可以是Ca、Sr、Ba等鹼土金屬和稀土元素以及Cu、Ag、H等。這類化合物具有鮮豔的顏色、金屬光澤、高的電導率以及快離子傳輸性質,其電導率可以達到2.5X106 S/m,而且是一種低溫超導體。
2.共生鎢青銅(ITB)
這類鎢青銅化合物是符合化學計量的,一般含B2O62-的共生鎢青銅(ITB),是由於O不足或者含有額外的B離子,或BO團佔據最大的間隙位置而形成的。通常,根據B位離子的價態將其表示成(AO)m.(B2O5)n或者(AO)m.(BO3)n,故稱其為共生鎢青銅,主要有BaO.(Nb2O5)2、BaO.(Ta2O5)2、Nb8W9O47。最近研究發現MxWO3(M=K, Rb, Cs, x=0.19~0.33)形成六方鎢青銅(HTB)。但隨著x降低(x< 0.10),六方鎢青銅變得不再穩定,而形成共生鎢青銅,其中WO3層與六方鎢青銅交替構成,因此現在將其稱為准二維鎢青銅。
3.四方鎢青銅
鎢青銅結構中的四方鎢青銅最常見、應用最廣泛,也是研究的焦點(其中許多正交鎢青銅結構是TTB的超結構,故這裏將其也歸為TTB這類)。因此通常所說的鎢青銅結構主要指TTB。
製備方法
1.濕化學法
這類方法首先被應用到HxWO3的製備中。普通的濕化學法的製備過程為:WO3 晶體浸在酸性和金屬粉末(Zn、Pb、Sn等)的溶液中,在特殊的容器(如Jones反應器等,能夠實現反應物同空氣的分離)裏進行反應,製備出氫鎢青銅,反應過程中氫進入到了WO3的規則空隙中。如用六方結構的WO3 和鹽酸、Zn 製備出了六方結構H0.3WO3,它具有類似金屬的導電性能;WO3在1mol/L的硫酸溶液中,以In作催化劑製備出了四方結構H0.23WO3。
通過先驅化合物在溶液中加熱分解也可製備出鎢青銅。如仲鎢酸銨,即(NH4)10(W12O41) 5H2O在非水溶液(冰醋酸、乙烯基乙二醇或二者以一定比例混合的溶液)中,一定壓力下,加熱到200 ℃,最後得到產物為六面體結構的(NH4)xWO3。
濕化學法由於其合成溫度相對較低,產物結晶狀態比較好等優點而成為合成方法中研究的熱點,但現在通過這種方法合成出來的鎢青銅種類還不是很多。
2.熱還原法
2.1相-相加熱還原法
這種製備鎢青銅的方法應用得比較早。製備過程如下:首先, WO3、金屬鎢粉末(或WO2 )和金屬M的鎢酸鹽按適當比例均勻混合,然後在惰性氣氛或真空下加熱,反應溫度一般在1 000 ℃左右。反應完成之後除去未反應的雜質,即可得到比較純淨的MxWO3。相關的反應方程式可表示為:
x/2M2WO4 + (1-x)WO3 + x/2WO2→MxWO3
2.2 熱分解法
這種方法即通過先驅化合物(主要是多酸配合物、過氧多酸配合物及一些含鎢的複雜化合物
等)加熱分解來製備鎢青銅,出現比較早的是偏鎢酸鹽和仲鎢酸鹽加熱分解製備鎢青銅。
例如:仲鎢酸銨熱分解製備氫鎢青銅步驟如下:
1)APT, 即(NH4)10(H2W12O42)7H2O,在100 ~200 ℃下分解為(NH4 )10(W12O41)5H2O;
2)(NH4 )10(W12O41)5H2O在200-250 ℃下繼續分解為(NH4)0.33WO3;
3)在250-575 ℃下,(NH4)0.33WO3表現出相對的穩定性,大量地轉變為H0.33WO3和WO3。
其中(NH4 )xWO3可分解製備HxWO3。這一過程的溫度範圍一般是150-350 ℃,同時,往往伴隨著晶形的轉變,用方程式表示:(NH4 )xWO3=HxWO3+xNH3(g)。
3.電化學法
這類方法是製備鎢青銅,尤其是氫鎢青銅和鋰鎢青銅比較常見的方法,而且製備過程中發生
的反應也是這兩種鎢青銅一些應用的基本反應。電化學法制備鎢青銅不需要較高的溫度,而且易獲得完好的晶體。其製備過程如下:首先將WO3按照一定的方法製成電極, 然後以WO3 電極為陰極, 以石墨、Pt等惰性電極或鋰薄等為陽極,在硫酸、硝酸或相應的鋰鹽中電解, 可得到氫鎢青銅及鋰鎢青銅。對應的陰極反應方程式為:
xH++WO3+xe=HxWO3
xLi++WO3+xe=LixWO3
性能及應用
鎢青銅具有良好的電子和離子導電性能、超導性能及光學性能等,有著廣闊的應用前景。在鎢青銅的這些性能中,超導性和導電性研究得比較早,尤其是超導性質,在六七十年代就已成為焦點。現在雖然也有關於鎢青銅導電類型和電子傳導方式的報導,但是導電性和超導性已經不再是性能研究的主要內容。
在一定條件下,補償離子嵌入到WO3 中之後形成鎢青銅,因為它對光波的吸收和散射而使自身具有顏色,並且吸收和散射的強度隨其x值的變化而變化,也使鎢青銅呈現出不同的顏色。H+、Li+、N a+和Ag+等離子嵌入而形成的鎢青銅光學性能比較突出,研究的也比較多。其中HxWO3 對光的吸收最強,Li+次之。但鋰和鈉鎢青銅都在x ≈ 0.6達到對光吸收的最大值,而氫鎢青銅則沒有最大。
電制變色裝置和光制變色裝置作為鎢青銅應用的兩個重要方面,光學性能是其基本原理之一。電制變色的應用也同H+、Li+等離子在WO3 電極上的電化學可逆嵌入有關。
光學嵌入是指H+、Li+和Na+等離子在光的照射下可逆地進入到WO3 固體中,也是鎢青銅的一個重要性能,是實現光制變色、光電轉化等應用的基本反應。因為介入後是WO3 和鎢青銅的混合物,也有人將這個效應看作是一個光學摻雜的過程。
濕敏特性、對一些化學物質的敏感特性等新的性能也可能使鎢青銅在濕度測量儀錶、化學感測器等裝置中實現有效的應用。